[PR]
[PR]上記の広告は3ヶ月以上新規記事投稿のないブログに表示されています。新しい記事を書く事で広告が消えます。

青天を行く白雲のごとき浮遊思考の落書き帳
[PR]上記の広告は3ヶ月以上新規記事投稿のないブログに表示されています。新しい記事を書く事で広告が消えます。
PCR検査は1980年代に発明されたが、当の発明者である生化学者キャリー・マリスは、PCR検査はウィルスの定量検査には使えない、と明言している。原理的に不可能だと。


それでは、PCR検査は何を見ているのか? 何の有無を確認しているのか?

検出できるのは “タンパク質”、つまり、遺伝子のDNAとかRNA といった “遺伝物質” である。


さて、彼は 「ウィルスの遺伝子配列は検出できる」 と言っているが、そのためにはあらかじめ当のそのウィルスが分離されていて、そのウィルスの遺伝子配列がわかっていることが前提だ。「これと同じものを探しに行く」 ということだ。しかし、たとえ見つかっても、それはウィルスそのものの存在を証明することにはならない。
しかも、新型コロナウィルス(COVID-19)と呼ばれているものは、実際にはまだ分離に成功しておらず、そのため感染実験も行われていないので、本当に存在するのかどうかすら疑われている。→ コロナ騒動:日本の一感染症専門家の視点:「新型コロナウィルスは存在しない」
それでは、「陽性だ!」 と言って、見つかったものがウィルスではないとしたら、それは何なのか?何が存在したということなのか?


それはどうやら細胞が放出する “エクソソーム” という小胞と考えられる。→コロナ騒動:新型コロナウィルスという病原体はそもそも実在するのか?

エクソソームは体外から侵入した病原体ではないし、病原体の感染によって増殖しているものでもない。
むしろ、毒素やストレスにさらされた生体の細胞が自己防衛のために放出するものである。
毒素を包んで細胞から排出する清掃人のような地味な仕事をしているものと考えられている。
PCR検査は、ウィルスではなく、この、細胞が放出しているエクソソームを検出して、病気の犯人に仕立てている可能性がある。


採取した検体中の遺伝物質を増幅する作業を重ねれば、わずかにでもあったエクソソームが増幅されてくる。そして、ほれ、「陽性だ!」 となるわけだ。増幅の回数を減らせば、ほれ、「陰性だ!」 となるかもしれない。
もともと持病がある人や高齢者といった免疫系がかなり弱体化している場合、当然エクソソームの分泌も多いので、陽性率は当然高くなる。がん、心臓疾患、肺炎ではエクソソームはいくらでも出てくる。
今年に限らず、いつだって死期の近い病人や高齢者の体内ではエクソソームが高濃度に放出されているのだが、今年はなぜか “PCR検査” というものによって、彼らの死因は自動的に 「新型コロナウィルス」 となる仕組みだ。
2012年4月2日(月)
大学院医学系研究科の山下 俊英教授と上野 将紀助教らは、脳障害後に運動機能が回復していくメカニズムを、マウスを用いた実験により明らかにしました。
脳血管障害や脳外傷などにより脳が障害を受けると神経回路が破壊され、手足の麻痺などの重い神経症状がもたらされます。しかし、失われた機能は、時間を経るとともにある程度回復することがあります。この要因として、損傷を免れた神経回路が、失われた機能を代償するのではないかと推定されていましたが、その実体は不明でした。
本研究グループは今回、マウスを用いて、広範な脳の損傷後においても新たな神経回路が形成されることにより、神経機能の自然回復がもたらされることを示し、そのメカニズムを明らかにしました。片側の大脳皮質運動野※1を損傷すると、運動をつかさどる皮質脊髄路(ひしつせきずいろ)※2が破壊され、反対側の半身(対側)の前後の足に重い運動障害が引き起こされますが、徐々に運動障害は回復します。その際、損傷されていない側の皮質脊髄路を調べてみたところ、その皮質脊髄路が脊髄内で新たな神経回路を形成して、運動機能を回復させることを発見しました(図1)。また、脊髄内で発現する神経栄養因子BDNF※3が、この新しい回路の形成を促していることが分かりました。
今回の発見を基盤として、サルやヒトなどの霊長類においても同様のメカニズムが働き得ることが分かれば、新たな治療法の開発やリハビリテーションの科学的基盤の構築につながるものと期待されます。
本研究成果は、2012年3月21日(英国時間)に英国科学雑誌「Brain」のオンライン速報版で公開されました。
なお、本研究は、独立行政法人 科学技術振興機構(JST) 戦略的創造研究推進事業チーム型研究(CREST)「脳神経回路の形成・動作原理の解明と制御技術の創出」研究領域(研究総括:小澤 瀞司)における研究課題「中枢神経障害後の神経回路再編成と機能回復のメカニズムの解明」(研究代表者:山下 俊英)の一環として行われたものです。
脳血管障害や脳挫傷により脳が障害を受けると、神経回路が破壊され、認知・運動・感覚といった神経機能に重い障害がもたらされます。こうした障害に対して、有効な治療法はいまだ確立されていないのが現状です。脳や脊髄(せきずい)などの中枢神経は、一度破壊されると再生できないと長く信じられてきたために、中枢神経損傷後の自然経過での機能回復については注目されず、科学的に解明されてきませんでした。しかし実際には、リハビリテーションなどによる訓練を行うことで、失われた機能がある程度回復する場合があります。この現象を説明する仮説として「障害を免れた神経回路が、失われた機能を代償するのではないか」と考えられてきましたが、神経回路がどのように変化して機能を代償するのか、さらにそのメカニズムは何かということに関しては不明でした。脳にもとから備わっている自発的な回復のメカニズムが解明されれば、脳障害による後遺症に対する治療法の開発に大きく貢献することが期待できます。
本研究グループはマウスを用いて、片側の大脳皮質運動野を広範に損傷させて、運動をつかさどる皮質脊髄路を片側だけ破壊しました。この実験モデルでは、損傷とは反対側の前後の足に重度の運動障害が起こります。通常、皮質脊髄路の軸索※4は、脳の下部で交差して、脊髄へと伸びます(図2:ヒトの場合。マウスも同様)。このために左側の脳が損傷を受けると、右側の足が麻痺します。しかし、損傷後数週間を経ると、運動機能が徐々に回復します。そこで、この自然回復がなぜ起きるのかを解析しました。
この脳損傷モデルでは、損傷部とは反対側の大脳皮質運動野から伸びる皮質脊髄路が残存していることから、この皮質脊髄路の変化に着目しました。軸索全体を可視化できる化合物「順行性トレーサー※5」を用いてこの皮質脊髄路を可視化したところ、脳損傷後にはこの皮質脊髄路が、頸部脊髄(けいぶせきずい:頸髄)において多数の枝を伸ばしていました。これらの枝は、通常は脊髄の同じ側に向かって伸びていますが、脳損傷後には、一部が身体の中心線(正中)を超えて反対側へと伸長していました(図3)。反対側へと伸長した枝は、脊髄介在神経細胞※6と接続し、脊髄介在神経細胞は下位運動神経(図2)とつながることで、大脳皮質から筋肉にまでバトンタッチされる神経回路を形成することができました。実際に、損傷されていない側の大脳皮質運動野を電気刺激すると、麻痺した側の前足の筋運動が引き起こされました。また、この神経回路を切断すると回復した運動機能は再び失われました(図4)。この実験結果は、損傷を受けていない側の大脳皮質が、損傷された側の大脳皮質の機能を代償することで、麻痺した前足を動かすことができるようになったことを示しています。頸髄において新たに形成された神経回路が、運動機能の自然回復に寄与することが実証されました。
本研究グループはさらに、このような新たな回路形成を引き起こす因子を同定することを目指しました。研究を進めた結果、脳由来神経栄養因子(BDNF)が頸髄の介在神経細胞に、その受容体であるTrkB(トラックビィ)が皮質脊髄路の枝にそれぞれ発現していることが分かりました。そこで、脳損傷後にBDNFあるいはTrkBの発現を抑制したところ、新たな回路形成は減少し、運動機能の回復も減弱しました。逆に、BDNFを過剰に発現させると回路形成が増加しました。これらの結果から、脳障害後の新たな回路形成には、BDNF-TrkBシグナルが必要であることが明らかになりました(図5)。
今回の発見をもとに、より高等な神経回路を持つサル・ヒトにおいて、脳血管障害や脳外傷などによる神経症状を回復させるメカニズムを明らかにしていくことが期待されます(図6)。特に、霊長類では一部の皮質脊髄路は交差せず、そのまま同側を下っていくことが知られており、これが脳障害後の機能回復に効果的に寄与する可能性があります。研究の進展によって、脳が自力で回復していく仕組みを知ることができるのです。さらに、代償性の神経回路形成を促進する治療法の開発、リハビリテーションの科学的な基盤の構築に寄与することが期待されます。

図1 本研究の概要:脳損傷後、損傷を免れた皮質脊髄路の回路が再編成され、運動機能の自然回復がもたらされる(マウスを用いた実験)
(A)健常時:皮質脊髄路は反対側の手足の運動機能を制御する。
(B)脳損傷直後:皮質脊髄路が脱落し(赤点線)、前足の運動障害を引き起こす。
(C)脳損傷の数週間後:反対側の皮質脊髄路が新たな回路を形成することにより(青矢印)、運動機能の自然回復をもたらす。

図2 運動を制御する神経回路
1)皮質脊髄路:脳の一部である延髄において対側に交差する。
2)下位運動神経:皮質脊髄路からの信号を受け、筋肉に刺激を伝える。
3)骨格筋:神経からの刺激を受け、運動を実行する。

図3 脳損傷後に、損傷されていない側の皮質脊髄路が脊髄内で回路を作る
順行性トレーサー(BDAという物質)で片側のみ赤色に標識された皮質脊髄路の軸索の枝が、脳損傷後、正中を越えて対側(赤色で標識されていなかった側)に伸長し(白矢印)、脊髄介在神経細胞(緑色)と接続している(白矢印)。

図4 新たに形成された神経回路は、前足の運動機能を回復させる
運動機能の回復度合いを、はしごを歩かせる「はしごテスト」によって測った。はしごを踏み外す回数が少ないほど、回復していると見なされる。
A:新たに形成された神経回路を電気刺激すると、前足の筋運動を引き起こす。
B:この回路を切断すると回復した運動機能は再び悪化する。

図5 BDNF-TrkBシグナルが新たな神経回路を作る
介在神経細胞から分泌されるBDNF(図中左、丸ピンクで示している)は皮質脊髄路の軸索(図中左、青矢印で示している)の伸長を促し、神経回路の形成に寄与する。BDNFあるいはTrkBを阻害すると軸索の枝の形成が減少し(図中右上の写真)、運動機能の回復も悪くなる(図中右下のグラフ)。

図6 今後の展望:治療法の開発へ
サル・ヒトにおいて、同様のメカニズムが働いているかを調べ、新たな治療薬の開発やリハビリテーションの科学的な基盤の構築につなげる。
|
|||
| 分類(ウイルス) | |||
|
|
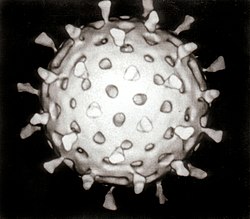
ウイルス(ラテン語: virus)は、他生物の細胞を利用して自己を複製させる、極微小な感染性の構造体で、タンパク質の殻とその内部に入っている核酸からなる。生命の最小単位である細胞やその生体膜である細胞膜も持たないので、小器官がなく、自己増殖することがないので、非生物とされることもある[1]。
「ウイルス」は、「毒液」または「粘液」を意味するラテン語 virus に由来して命名された。古代ギリシアのヒポクラテスは病気を引き起こす毒という意味でこの言葉を用いている[要出典]。
ウイルスは細胞を構成単位とせず、自己増殖はできないが、遺伝子を有するという、非生物・生物両方の特性を持っている。自然科学・生物学上、生物・生命の定義を厳密に行うことはできていないため、便宜的に細胞を構成単位とし、代謝し、自己増殖できるものを生物と呼んでおり、ウイルスは「非細胞性生物」あるいは「生物学的存在」と見なされている[15]。感染することで宿主の恒常性に影響を及ぼし、病原体としてふるまうことがある。ウイルスを対象として研究する分野はウイルス学と呼ばれる。
遺伝物質の違いから、大きくDNAウイルスとRNAウイルスに分けられる(詳細はウイルスの分類を参照)。
微生物学の歴史は、1674年にオランダのレーヴェンフックが顕微鏡観察によって細菌を見出したことに始まり、その後1860年にフランスのルイ・パスツールが生物学や醸造学における意義を、1876年にドイツのロベルト・コッホが医学における意義を明らかにしたことで大きく展開した。特にコッホが発見し提唱した「感染症が病原性細菌によって起きる」という考えが医学に与えた影響は大きく、それ以降、感染症の原因は寄生虫を除いて全て細菌によるものだと考えられていた。
1892年、ロシアのドミトリー・イワノフスキーは、タバコモザイク病の病原が細菌濾過器を通過しても感染性を失わないことを発見、それが細菌よりも微小な、光学顕微鏡では観察できない存在であることを報告した。またこの研究とは別に、1898年にドイツのフリードリヒ・レフラーとパウル・フロッシュが口蹄疫の病原体の分離を試み、これが同様の存在であることを突き止め、「filterable virus(濾過性病原体)」と呼称した。同年にオランダのマルティヌス・ベイエリンクはイワノフスキーと同様の研究を行って、同じように見出された未知の性質を持つ病原体を「Contagium vivum fluidum(生命を持った感染性の液体)」と呼んだ。
レフラーは濾過性病原体を小さな細菌と考えていたが、ベイエリンクは分子であると考え、これが細胞に感染して増殖すると主張した。彼の主張はすぐには受け入れられなかったが、同様の性質をもった病原体やファージが発見されていくことで、一般にもウイルスの存在が信じられるようになった。その後、物理化学的な性質が徐々に解明され、ウイルスはタンパク質からできていると考えられた。1935年、アメリカのウェンデル・スタンリーがタバコモザイクウイルスの結晶化に成功し、これによってはじめてウイルスは電子顕微鏡によって可視化されることとなった[16]。また彼の発見したこの結晶は、感染能を持っていることを示し、化学物質のように結晶化できる生物の存在は生物学・科学界に衝撃を与えた。彼はこの業績により、1946年にノーベル化学賞を受賞した[17]。スタンリーはウイルスが自己触媒能をもつ巨大なタンパク質であるとしたが、翌年に少量のRNAが含まれることが示された。当時は遺伝子の正体は未解明であり、遺伝子タンパク質説が有力とされていた。当時は、病原体は能動的に病気を引き起こすと考えられていたので、分子ロボット(今で言うナノマシン)のようなもので人が病気になるということに当時の科学者たちは驚いた。それでも当時はまだ、病原体であるには細菌ほどの複雑な構造、少なくとも自己のタンパク質をコードする遺伝子ぐらいは最低限持っていなくては病原体になりえない、と思われていた。
1952年に行われたハーシーとチェイスの実験は、バクテリオファージにおいてDNAが遺伝子の役割を持つことを明らかにし[18]、これを契機にウイルスの繁殖、ひいてはウイルスの性質そのものの研究が進むようになった。同時に、この実験は生物の遺伝子がDNAであることを示したものと解せられた。
| 一般的な原核生物 (例:大腸菌) | マイコプラズマ | ナノアルカエウム・エクウィタンス | リケッチア | クラミジア | ファイトプラズマ | ウイルス | |
|---|---|---|---|---|---|---|---|
| 構成単位 | 細胞 | ウイルス粒子 | |||||
| 遺伝情報の担体 | DNA | DNAまたはRNA | |||||
| 増殖様式 | 対数増殖(分裂や出芽) | 一段階増殖 暗黒期の存在 |
|||||
| ATPの合成 | できる | できない | できる | できない | |||
| タンパク質の合成 | できる | できない | |||||
| 細胞壁 | ある | ない | ある | ない | |||
| 単独で増殖 | できる | できない (他生物に付着) |
できない(偏性細胞内寄生性) | ||||
ウイルスによる感染は、宿主となった生物に細胞レベルや個体レベルでさまざまな影響を与える。その多くの場合、ウイルスが病原体として作用し、宿主にダメージを与えるが、一部のファージやレトロウイルスなどに見られるように、ウイルスが外来遺伝子の運び屋として作用し、宿主の生存に有利に働く例も知られている。
ウイルスが感染して増殖すると、宿主細胞が本来自分自身のために産生・利用していたエネルギーや、アミノ酸などの栄養源がウイルスの粒子複製のために奪われ、いわば「ウイルスに乗っ取られた」状態になる。
これに対して宿主細胞はタンパク質や遺伝子の合成を全体的に抑制することで抵抗しようとし、一方でウイルスは自分の複製をより効率的に行うために、さまざまなウイルス遺伝子産物を利用して、宿主細胞の生理機能を制御しようとする。またウイルスが自分自身のタンパク質を一時に大量合成することは細胞にとって生理的なストレスになり、また完成した粒子を放出するときには宿主の細胞膜や細胞壁を破壊する場合もある。このような原因から、ウイルスが感染した細胞ではさまざまな生理的・形態的な変化が現れる。
この現象のうち特に形態的な変化を示すものを細胞変性効果 (cytopathic effect, CPE) と呼ぶ。ウイルスによっては、特定の宿主細胞に形態的に特徴のある細胞変性効果を起こすものがあり、これがウイルスを鑑別する上での重要な手がかりの一つになっている。代表的な細胞変性効果としては、細胞の円形化・細胞同士の融合による合胞体 (synsitium) の形成・封入体の形成などが知られる。
さまざまな生理機能の変化によって、ウイルスが感染した細胞は最終的に以下のいずれかの運命を辿る。
ウイルス感染は、細胞レベルだけでなく多細胞生物の個体レベルでも、さまざまな病気を引き起こす。このような病気を総称してウイルス感染症と呼ぶ。インフルエンザや天然痘、麻疹、風疹、後天性免疫不全症候群(AIDS)などの病気がウイルス感染症に属しており、これらのウイルスはしばしばパンデミックを引き起こして人類に多くの犠牲者を出した。
また、動物ではウイルス感染が起きると、それに抵抗して免疫応答が引き起こされる。血液中や粘液中のウイルス粒子そのものに対しては、ウイルスに対する中和抗体が作用する(液性免疫)ことで感染を防ぐ。感染した後の細胞内のウイルスに対しては抗体は無効であるが、細胞傷害性T細胞やNK細胞などが感染細胞を殺す(細胞性免疫)ことで感染の拡大を防ぐ。免疫応答はまた、特定のウイルス感染に対して人工的に免疫を付与するワクチンによっても産生され得る。AIDSやウイルス性肝炎の原因となるものを含む一部のウイルスは、これらの免疫応答を回避し、慢性感染症を引き起こす。
ウイルス感染症における症状の中には、ウイルス感染自体による身体の異常もあるが、むしろ発熱、感染細胞のアポトーシスなどによる組織傷害のように、上記のような免疫応答を含む、対ウイルス性の身体の防御機構の発現自体が健康な身体の生理機構を変化させ、さらには身体恒常性に対するダメージともなり、疾患の症状として現れるものが多い。
パソコン作業などを長時間続けると、水晶体を伸ばしたり縮めたりしてピントを合わせている毛様体筋という筋肉の緊張状態が続き、ピントを合わせる機能が低下して、視界が一時的にかすむことがあります。
※老眼(加齢による機能の低下)が原因の場合
年齢を重ねると、次第に水晶体の弾力性や、水晶体の厚さを調節する毛様体筋の働きが低下し、ピントを合わせるのが難しくなります。このため近くのモノが見えにくくなります。